LEY DE LOS GASES IDEALES
Es la ecuación del estado del gas ideal, un gas hipotéticamente formado por partícula puntuales si atracción ni repulsión entre ellas cuyos choques son perfectamente elásticos (conservación de momento y energia cinética). La energia cinética es directamente proporcional a la temperatura en un gas ideal.
Los gases reales que mas se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Los gases reales que mas se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
LEY DE BOYLE
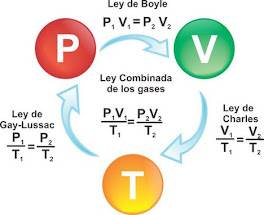
La ley de Boyle afirma que presión y el volumen son inversamente proporcionales entre si a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la presión y la temperatura absoluta siempre y cuando se encuentren a un volumen constante.
La ley de Boyle fue descubierta por Robert Boyle en el siglo XVII, y fue la ley que estableció las bases para poder explicar la relación que existe entre la presión y el volumen que existe en un gas. Por medio de una seri de experimentos, logro demostrar que, si había una temperatura constante, un gas al ser sometido a mas presión reduce su volumen, mientras que si la presión decrece el volumen aumenta.
La ley de Boyle puede ser expresada de forma matemática de la siguiente manera: P x V=K
Donde:
P es Presión
V es volumen
K es una constante que nos indica cuando la temperatura y masa son constantes.

LEY DE CHARLES
Es bastante interesante que muchas sustancias diferentes se comporten exactamente igual. La explicación aceptada, que James Clerk Maxwell planteo alrededor de 1860, es que la cantidad de espacio que ocupa un gas depende puramente del movimiento de las moléculas de gas .
En condiciones normales, las moléculas de gas están muy lejos de sus vecinos, y son tan pequeñas que su propio volumen es insignificante. La ley de Charles es una ley de gas que establece que los gases se expanden cuando se calienta. La ley también se conoce como la ley de los volúmenes.
La ley de Charles es una de la leyes que se encuentra relacionada con los gases. Consiste en la relación que existe entre el volumen y la temperatura de una cierta cantidad de gas ideal, el cual se mantiene a una presión constante, por medio de una constante de proporcionalidad que se aplica de forma directa. Jacques Charles dice que para una determinada suma de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye por que la temperatura se encuentra directamente relacionada con la energia del movimiento que tienen las moléculas de un gas a una presión dada, se dará una mayor velocidad de las moléculas y mayor volumen del gas.
La ley de Charles en su versión moderna señala que el volumen y la temperatura de un gas son directamente proporcionales. Entonces: V/T=K
V=
volumen de gas
volumen de gas
T= temperatura Kelvin
K= constante de proporcionalidad
Para un volumen V1 y una temperatura T1
LEY DE GAY-LUSSAC
Uno de los aspectos mas asombrosos que podemos conocer sobre los gases es que, a pesar de las grandes diferencias en las propiedades químicas que tiene cada uno de ellos, todos los gases obedecen mas o menos a las leyes de los gases. Las leyes de los gases se refieren a como se comportan los gases con respecto a la presión, el volumen, la temperatura y la cantidad.
La ley de Gay-Lussac es una ley que nos dice que dependiendo del volumen que exista de manera constante, la presión de un gas será directamente proporcional a la temperatura. Cuando se aumenta la temperatura, las moléculas que tiene un gas se movilizan mas rápidamente y por esta razón aumenta el numero de choques que se da contra las paredes, en otras palabras, se aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Consiste en establecer una relación entre la presión y la temperatura de un gas ideal, manteniéndolo a un volumen constante, por medio de una constante de proporcionalidad directa. En la que se nos dice que cuando hay un volumen constante, al aumentar la temperatura, la presión del gas aumenta y cuando se disminuye la temperatura, presión del gas disminuye.
De acuerdo con el enunciado, la ley de Gay-Lussac puede expresarse matemáticamente de la siguiente manera
P1/T1 = K
V = volumen
T = temperatura
K = constante






No hay comentarios.:
Publicar un comentario